Modelos Atômicos e Estrutura Eletrônica
Evolução do conhecimento sobre a estrutura da matéria
MODELOS ATÔMICOS
O fato de radiações atravessarem corpos maciços levou o cientista Ernest Rutherford a concluir que o átomo, além de divisível, é constituído de espaços vazios.
Química é a ciência que estuda a matéria, suas propriedades e transformações.
Matéria é tudo que tem massa e ocupa lugar no espaço, como o ar, a água, o solo. A constituição da matéria desperta curiosidade no ser humano desde os tempos mais remotos. Os filósofos gregos Leucipo e Demócrito (450 a.C.) já imaginavam que a matéria pudesse ser dividida em pedaços cada vez menores, até chegar a uma porção indivisível, que eles denominaram átomo (do grego, a - não; tomo - divisão). Essa era uma concepeção puramente filosófica.
Lavoisier e Proust constataram que, em reações químicas, uma substância se transforma em outra sem alterar a massa total do sistema. Baseado nessas observações, em 1803, o cientista inglês John Dalton elaborou a teoria atômica clássica, cujos principais pontos estão relacionados a seguir.
- Toda a matéria é formada por átomos.
- Os átomos são esféricos, maciços, indivisíveis e indestrutíveis.
- Átomos de uma mesma substância simples são todos iguais; átomos de substâncias diferentes diferem na massa.
- Os átomos unem-se em proporções bem-definidas, formando as substâncias químicas, representadas pelas moléculas.
A idéia do átomo como partícula indivisível caiu por terra com a descoberta das partíulas elementares - próton, elétron e nêutron.
O próton é portador de carga elétrica positiva, e o elétron, de negativa. Em módulo, as cargas elétricas do próton e do elétron são iguais. Em termos de massa, o próton é muito mais pesado que o elétron. Medidas experimentais mostram a massa do próton cerca de 1836 vezes maior que a do elétron.
| Próton | Nêutron | Elétron | |
|---|---|---|---|
| Carga | +1 | 0 | -1 |
| Massa | 1 | 1 | 1/1836 |
Massas e cargas relativas não representam medidas reais; elas servem apenas para a comparação entre partículas.
As descobertas do próton e do elétron, bem como as experiências no campo da eletricidade e da radiotividade mostraram que a concepção do átomo indivisível não mais poderia ser aceita.
Em 1904. Thomson propôs um novo modelo: o átomo seria formado por uma esfera de carga elétrica positiva, possuindo, na superfície, elétrons incrustados. Assim, a carga elétrica total de um átomo seria nula, pois a carga negativa dos elétrons compensaria a carga positiva da esfera que os contêm. Isso é conhecido por modelo do pudim de passas.
Thomson considerava que a matéria era formada por átomos justapostos, praticamente sem espaços vazios entre si.
Rutherford realizou um experimento que conseguiu descartar definitivamente o modelo atômico da esfera rígida. Bombardeou uma fina lâmina de ouro (cerca de 0,0001 mm de espessura) com partículas alfa, emitidas pelo elemento radioativo polônio (Po). Ele sabia que as partículas alfa eram positivas, tinham massa elevada e produziam luminescência ao colidirem com o anteparo de sulfeto de zinco (ZnS).
A maioria das partículas atravessou a lâmina de ouro numa trajetória retilínea, demonstrando ser o átomo descontínuo, com predominância de espaços vazios.
Algumas partículas alfa sofriam desvio de trajetória, enquanto outras se refletiam, iluminando a parte frontal da placa de ouro. Isso indicou a existência de uma região central no átomo, muito pequena e maciça - o núcleo -, carregado de partículas positivas - os prótons.
Rutherford propôs, então, o modelo planetário do átomo, com elétrons girando ao redor do núcleo.
O átomo é formado por um núcleo pequeno pesado e positivo, em que ficam os prótons, e pela eletrosfera, região ao redor do núcleo na qual giram os elétrons.
Medindo o ângulo de desvio das partículas alfa e fazendo contagem radioativa, o cientista concluiu que o raio do núcleo é dez mil vezes menor que o raio do átomo.
O grande mérito do modelo de Rutherford foi incluir a noção de núcleo e eletrosfera, pondo fim à idéia de átomo maciço.
O núcleo, apesar de muito pequeno, concentra quase toda a massa do átomo, pois os prótons são muito mais pesados que os elétrons.
Elétrons
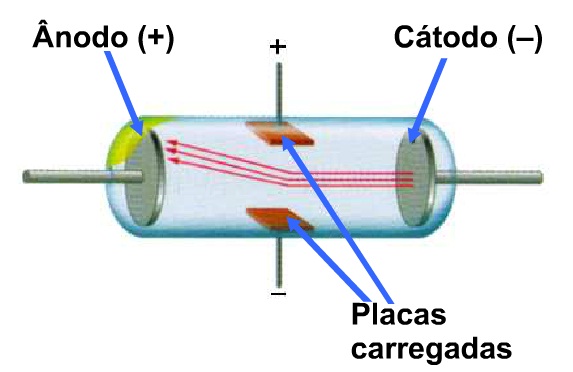
A descoberta do elétron e do próton aconteceu em experiências de descargas elétricas em gases à baixíssima pressão, em tubos de vidro denominados ampolas de Crookes.

A aplicação de alta voltagem nos terminais da ampola provoca raios emitidos pelo cátodo (raios catódicos). Esses raios são formados por partículas negativas - elétrons - dotados de massa, que se propagam em linha reta.
Prótons
Goldstein descobriu os prótons usando a ampola de Crookes, com hidrogênio como gás residual e cátodo perfurado. Aplicando alta voltagem entre os eletrodos, surgem raios que parecem sair dos orifícios do cátodo, por isso chamados raios canais ou anódicos. Estes são formados de partículas positivas - prótons.
Nêutrons
J. Chadwick descobriu os nêutrons quando realizava experiências no campo da radiotividade.
ELEMENTO QUÍMICO
Estudos mostram que a energia do Sol vem de reações de fusão nuclear. Núcleos de átomos de hidrogênio, de massas diferentes, unem-se, formando átomos de hélio e liberando muita energia. Um exemplo de fusão pode ser representado por
Os átomos de hidrogênio representados denominam-se isótopos, porque apresentam o mesmo número de prótons, diferindo apenas no número de massa.
O aprofundamento do estudo do átomo permitiu constatar a característica que melhor define as propriedades de um elemento químico: o número de prótons no núcleo.
Concluiu-se, então, que os átomos de um elemento químico apresentam o mesmo número de prótons no núcleo. Todos os átomos com apenas um próton no núcleo constituem o elemento químico hidrogênio, por exemplo.
Elemento químico é o conjunto de átomos com o mesmo número de prótons, ou seja, o mesmo número atômico.
Por caracterizar cada elemento químico, o número de prótons recebe o nome de número atômico. Por exemplo, o elemento químico hidrogênio (H) apresenta um próton no núcleo, logo seu número atômico é 1.
Número atômico (Z) é o número de prótons de um átomo. $$\text{Z = P}$$
Número de massa (A) de um átomo é a soma do número de prótons com o número de nêutrons desse átomo. $$\text{A = Z + n}$$ Um átomo de sódio, por exemplo, apresenta núcleo com 11 prótons e 12 nêutrons; logo seu número de massa é dado por $\text{A} = 11 + 12 \to \text{A} = 23$.
Massas e cargas relativas não representam medidas reais; elas servem apenas para a comparação entre partículas.
Cada elemento químico tem nome e símbolo que o representa.
Hidrogênio - $\text{H}$
Oxigênio - $\text{O}$
Ouro - $\text{Au}$ (de aurum)
Prata - $\text{Ag}$ (de argentum)
Sódio - $\text{Na}$ (de natrium)
Enxofre - $\text{S}$ (de sulfur)
É habitual representar o elemento químico (E) pelo símbolo acompanhado de número atômico (Z) e número de massa (A), segundo os modelos: $$_Z \text{E}^A \text{ } ou \text{ } _Z^A \text{E}$$ Átomo de sódio (Na), com 11 prótons e 12 nêutrons, por exemplo. $$_{11} \text{Na}^{23}$$
Íons
O átomo é um sistema eletricamente neutro, pois o número de prótons (Z) é igual ao número de elétrons. No entanto, um átomo pode ganhar elétrons, transformando-se em íon negativo (ânion), ou perder elétrons, transformando-se em íon positivo (cátion).
Íons são átomos ou grupos de átomos carregados eletricamente.
Átomo neutro $\to \text{p}^ + = \text{e}^-$
$$ \text{p}^+ \text{ }\neq \text{e}^- \begin{cases} \text{cation (+)}, & \text{se p}^+ \gt \text{e}^- \\ \text{anion (-)}, & \text{se p}^+ \lt \text{e}^- \end{cases} $$
Exemplo: $$_{11}\text{Na } \to \text{ } _{11}\text{Na}^{1+} \text{ + } 1\text{e}^-$$
Espécies químicas isoeletrônicas são aquelas que têm o mesmo número de elétrons.
Exemplo: $$_{10}\text{Ne, } _{11}\text{Na}^{1+} \text{, } _{12}\text{Mg}^{2+} \text{, } _{8}\text{O}^{2-} \to$$ tanto o átomo de neônio como os íons sódio, magnésio e oxigênio apresentam 10 elétrons.
Isótopos
Nem todos os átomos de um mesmo elemento químico são exatamente iguais. Todos têm o mesmo número de prótons, mas podem diferir no número de nêutrons e, consequentemente, no número de massa.
Isótopos são átomos de um mesmo elemento químico, com o mesmo número atômico e diferente número de massa. O elemento hidrogênio, por exemplo, apresenta os isótopos prótio, deutério e trítio.
| $_1 \text{H}^1$ | $_1 \text{H}^2$ | $_1 \text{H}^3$ |
|---|---|---|
| $\text{Z = 1}$ | $\text{Z = 1}$ | $\text{Z = 1}$ |
| $\text{n = 0}$ | $\text{n = 1}$ | $\text{n = 2}$ |
Isóbaros
São átomos de elementos químicos diferentes (diferentes números atômicos) e com o mesmo número de massa.
| $_{20} \text{Ca}^{40}$ | $_{18} \text{Ar}^{40}$ |
|---|---|
| $\text{A = 40}$ | $\text{A = 40}$ |
| $\text{Z = 20}$ | $\text{Z = 18}$ |
Isótonos
São átomos de elementos químicos diferentes (diferentes números atômicos) e com o mesmo número de nêutrons.
| $_{20} \text{Ca}^{40}$ | $_{19} \text{K}^{39}$ |
|---|---|
| $\text{A = 40}$ | $\text{A = 39}$ |
| $\text{Z = 20}$ | $\text{Z = 19}$ |
ELETROSFERA: MODELO ATÔMICO DE BOHR
Em 1913, Niels Bohr, fundamentado na análise do espectro de emissão do hidrogênio (decomposição da luz emitida pelo hidrogênio) e na mecânica quântica de Max Planck, propôs que os elétrons dos átomos, ao girarem ao redor do núcleo, não obedeciam às leis da teoria eletromagnética clássica, mas à mecânica quântica.
O modelo atômico de Bohr baseia-se nos seguintes postulados:
- Os elétrons descrevem órbitas circulares ao redor do núcleo, sem emitir nem absorver energia espontaneamente.
- Todos os elétrons de determinada camada apresentam a mesma energia, motivo pelo qual a camada é também denominada nível de energia.
- Somente são possíveis níveis para os quais a energia seja um múltiplo inteiro do produto $h\nu$ ($h$: constante de Planck; $\nu$: frequência de radiação).
Um elétron pode absorver quantidade bem-definida de energia (quantum de energia) ficar excitado e saltar da órbita estável para outra de maior energia.
O elétron excitado salta de volta para a órbita estável, liberando um quantum de energia igual ao que ele havia absorvido. A energia liberada pelo elétron é irradiada na forma de luz ou outra radiação eletromagnética. O quantum de luz denomina-se fóton.

As órbitas eletrônicas para os átomos conhecidos agrupam-se em sete camadas (teoricamente infinitas) - K, L, M, N, O, P, Q -, com a energia crescendo no sentido de K para Q.
Número quântico principal (n)
O número quântico principal, teoricamente infinito, tem por símbolo a letra n. Representa os níveis ou camadas de energia do elétron, expressa pelos números de 1 a 7.
Portanto, quanto maior o número quântico principal (n), maior a distância do elétron ao núcleo. Com a energia crescente, a distância entre as camadas diminui, mostrando que a diferença entre duas camadas consecutivas é cada vez menor, à medida que elas se afastam do núcleo.
Determina-se o número máximo de elétrons previsto para cada camada pela equação de Rydberg: $X = 2n^2$ ($X$ corresponde ao número máximo de elétrons e $n$, ao número quântico principal). Porém a partir da camada O, observa-se que o número máximo previsto de elétrons não coincide com o número encontrado na prática.

| Camada ou níveis | $\text{K}$ | $\text{L}$ | $\text{M}$ | $\text{N}$ | $\text{O}$ | $\text{P}$ | $\text{Q}$ |
|---|---|---|---|---|---|---|---|
| Nº quântico principal (n) | $\text{1}$ | $\text{2}$ | $\text{3}$ | $\text{4}$ | $\text{5}$ | $\text{6}$ | $\text{7}$ |
| Nº máximo de elétrons | $\text{2}$ | $\text{8}$ | $\text{18}$ | $\text{32}$ | $\text{50}$ | $\text{72}$ | $\text{98}$ |
| Nº máximo de elétrons prático | $\text{2}$ | $\text{8}$ | $\text{18}$ | $\text{32}$ | $\text{32}$ | $\text{18}$ | $\text{2}$ |
Trabalhando-se com elementos químicos mais complexos que o hidrogênio, notou-se que a eletrosfera apresentava subníveis de energia. Assim, elétrons de um mesmo nível poderiam apresentar energias diferentes, desde que ocupassem subníveis diferentes.
Em 1915, Sommerfield explicou as diferenças de energia para elétrons de um mesmo nível, admitindo que, além das órbitas circulares propostas por Bohr, eles poderiam apresentar, também, órbitas elípticas de diferentes excentricidades.
Teoricamente, cada nível (n) apresenta n subníveis. Para os átomos conhecidos, entretanto, os subníveis existentes denominam-se s (sharp), p (principal), d (difuse) e f (fundamental).
| Níveis (n) | Subníveis | ||||||
|---|---|---|---|---|---|---|---|
| $\text{K}$ | $\text{s}$ | ||||||
| $\text{L}$ | $\text{s}$ | $\text{p}$ | |||||
| $\text{M}$ | $\text{s}$ | $\text{p}$ | $\text{d}$ | ||||
| $\text{N}$ | $\text{s}$ | $\text{p}$ | $\text{d}$ | $\text{f}$ | |||
| $\text{O}$ | $\text{s}$ | $\text{p}$ | $\text{d}$ | $\text{f}$ | $\text{g}$ | ||
| $\text{P}$ | $\text{s}$ | $\text{p}$ | $\text{d}$ | $\text{f}$ | $\text{g}$ | $\text{h}$ | |
| $\text{Q}$ | $\text{s}$ | $\text{p}$ | $\text{d}$ | $\text{f}$ | $\text{g}$ | $\text{h}$ | $\text{l}$ |
Número quântico secundário ou azimutal (l)
Os subníveis de energia também podem ser representados pelos números quânticos secundários ou azimutais, simbolicamente anotados $l$, com valores que variam de 0 a n-1.
Calcula-se o número máximo de elétrons para cada subnível pela equação $X = 4l + 2$ ($X$: número máximo de elétrons; $l$: número quântico secundário).
| Subníveis | s | p | d | f | g | h | l |
|---|---|---|---|---|---|---|---|
| Nº quântico secundário ($l$) | $\text{0}$ | $\text{1}$ | $\text{2}$ | $\text{3}$ | $\text{4}$ | $\text{5}$ | $\text{6}$ |
| Máximo de elétrons | $\text{2}$ | $\text{6}$ | $\text{10}$ | $\text{14}$ | $\text{18}$ | $\text{22}$ | $\text{26}$ |


