Tipos de Ligação Química
Ligações iônicas, covalentes, orbitais moleculares e hibridação
LIGAÇÕES QUÍMICAS
Átomos adquirem estabilidade com oito elétrons na camada de valência ou dois elétrons na camada $\text{K}$
Muitas propriedades das substâncias químicas se explicam pelos tipos de ligações químicas que ocorrem entre seus átomos e pelo arranjo espacial decorrente dessas ligações. Os átomos fazem ligações químicas para alcançarem a estabilidade eletrônica de suas camadas de valência. Essa estabilidade é observada nos gases nobres, que apresentam oito elétrons na camada de valência - regra do octeto. O hélio é exceção: tem apenas dois elétrons na camada $\text{K}$ - regra do dueto.
Os principais tipos de ligação entre os átomos são: iônica, covalente e metálica.
LIGAÇÃO IÔNICA
A ligação iônica ou eletrovalente é a força de atração, de natureza elétrica, que se estabelece entre cátions e ânions, após a transferência de elétrons. Ocorre normalmente entre metais e não-metais, por causa da grande diferença de eletronegatividade entre eles. Ao ceder elétrons (oxidação), os metais transformam-se em cátions estáveis; os não-metais, ao receberem elétrons (redução), tornam-se ânions estáveis. Os íons obtidos unem-se por conta da atração eletrostática que surge entre eles.
Segundo Linus Pauling, a ligação iônica acontece quando a diferença de eletronegatividade entre os átomos ligantes for superior a $\text{1,7}$, numa escala de eletronegatividade que vai de $\text{0,0}$ (gases nobres) a $\text{4,0}$ (flúor).
Seja a interação entre um átomo de sódio ($\text{Na}$, $\text{Z = 11}$) e um átomo de cloro ($\text{Cl}$, $\text{Z = 17}$). Para que ambos adquiram oito elétrons na última camada, é necessário que o sódio doe um elétron ao cloro.
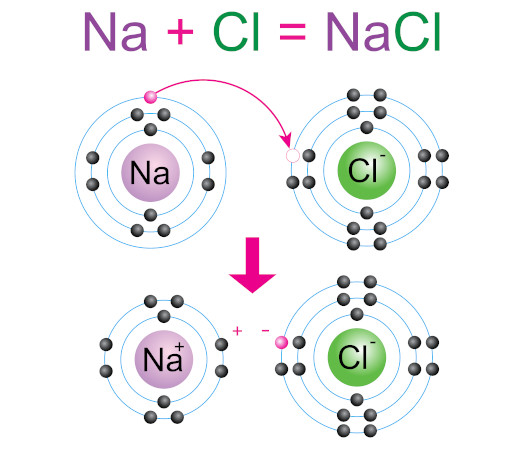
Desse modo tem-se:
Notação de Lewis
A notação de Lewis é uma forma de representar os elétrons da camada de valência.
Os íons $\text{Na}^+$ e $\text{Cl}^-$ atraem-se por forças eletrostáticas denominadas ligações iônicas, originando a substância cloreto de sódio ou sal de cozinha. Vários cátions se mantêm unidos a vários ânions, formando o retículo cristalino $\text{NaCl}$.
$\text{NaCl}$ é a representação simplificada da estrutura do sal de cozinha.
Íon-fórmula
No exemplo do $\text{NaCl}$, bastaram dois íons para a estabilização. Há, entretanto, casos em que os octetos só se completam com a participação de vários átomos, como ocorre com o óxido de alumínio.
Representando somente a última camada segundo o esquema de Lewis, tem-se:

Na prática, o íon-fórmula pode ser escrito $\text{Al}_2\text{O}_3$, que indica ser a proporção entre cátions e ânions $2:3$. As cargas adquiridas para cada íon são $+3$ e $-2$: cada alumínio cede três elétrons e cada oxigênio recebe dois elétrons. No total, foram cedidos seis elétrons pelos alumínios e recebidos seis pelos oxigênios.
Em um íon-fórmula, a carga total é igual a zero.
Alguns dos íons mais importantes na obtenção de compostos químicos estão representados na tabela a seguir.
| Nox dos ânions | $\text{-1}$ | $\text{F Cl Br I}$ | |
| $\text{-2}$ | $\text{O S Se Te}$ | ||
| $\text{-3}$ | $\text{N P}$ | ||
| Nox dos cátions fixos | $\text{+1}$ | $\text{Li Na K Rb Cs Fr Ag}$ | |
| $\text{+2}$ | $\text{Be Mg Ca Sr Ba Ra Zn Cd}$ | ||
| $\text{+3}$ | $\text{Al}$ | ||
| $\text{+4}$ | $\text{Si}$ | ||
| Nox dos cátions variáveis | $\text{+1 +2}$ | $\text{Cu Hg}$ | |
| $\text{+1 +3}$ | $\text{Au}$ | ||
| $\text{+2 +3}$ | $\text{Fe Co Ni Cr}$ | ||
| $\text{+2 +4}$ | $\text{Sn Pb Mn Pt}$ | ||
| $\text{+3 +5}$ | $\text{As Sb}$ |
De forma prática, conhecendo as cargas dos cátions e dos ânions, pode-se obter o íon-fórmula, observando os passos a seguir.
1. Escrever o cátion do lado esquerdo e o ânion do lado direito, com os respectivos nox.
$$ \text{Ca}^{2+}\text{ }\text{S}^{2-}\text{ , } \text{Ba}^{2+}\text{ }\text{Cl}^{1-}\text{ , } \text{Al}^{3+}\text{ }\text{S}^{2-} $$2. Colocar como índice do cátion o nox do ânion e vice-versa.
$$ \text{Ca}_2^{2+}\text{ }\text{S}_2^{2-}\text{ , } \text{Ba}^{2+}\text{ }\text{Cl}_2^{1-}\text{ , } \text{Al}_2^{3+}\text{ }\text{S}_3^{2-} $$3. Simplificar os índices quando for possível. Não escrever o índice 1.
$$ \text{CaS}\text{ , }\text{BaCl}_2\text{ , }\text{Al}_2\text{O}_3 $$Propriedades dos compostos iônicos
Os compostos iônicos são sólidos cristalinos de elevado ponto de fusão, que conduzem corrente elétrica quando em solução aquosa ou fundidos. Em solução aquosa, sofrem dissociação em cátion e ânion.
LIGAÇÕES COVALENTES
Ligação covalente ou molecular é a que se estabelece por meio do compartilhamento de pares de elétrons, localizados em orbitais incompletos (elétrons desemparelhados) de átomos, com tendência a ganhar elétrons. Os átomos ligantes associam seus orbitais incompletos, formando pares de elétrons que os estabilizam. O composto formado denomina-se covalente ou molecular.
Denomina-se covalência cada compartilhamento de elétrons de que o átomo necessita para se estabilizar. O carbono, por exemplo, faz quatro ligações, logo é tetravalente.
A associação dos orbitais incompletos gera atração magnética entre os átomos. Podem-se relacionar os elementos que participam de ligações covalentes com o esquema a seguir.
Classificação
De acordo com o número de pares de elétrons compartilhados, as ligações covalentes classificam-se em simples, dupla e tripla.
Ligação covalente normal
Na ligação entre dois átomos de hidrogênio, é possível perceber que ambos, possuindo apenas um elétron na camada $\text{K}$, precisam de um elétron para atingir a estabilidade.
Na ligação entre dois átomos de cloro, é possível perceber que ambos, por possuírem sete elétrons na última camada, precisam de um para completar o octeto.
Na molécula de $\text{O}_2$ há compartilhamento de dois pares de elétrons.
Entre dois átomos podem existir até três ligações, como na molécula do gás nitrogênio.
Ligação covalente coordenada
Neste tipo de ligação, um dos elementos "empresta" os dois elétrons a serem compartilhados.
Seja a formação da molécula do gás sulfuroso ($\text{SO}_2$):
Se os átomos ficam com oito elétrons, como explicar a ocorrência do segundo oxigênio?
A explicação é que o átomo de enxofre cede o par de elétrons para formar a ligação.
Este tipo de ligação normalmente é representado na fórmula estrutural plana com uma seta partindo do elemento que "empresta" o par eletrônico em direção ao que recebe. Um átomo fará ligação coordenada somente após ter atingido a estabilidade.
Fórmulas estruturais
Na montagem de uma fórmula estrutural plana, primeiramente se estabelecem todas as ligações covalentes normais que os átomos podem realizar. Caso algum deles não tenha completado o octeto, utilizam-se as ligações coordenadas.

Em fórmulas do tipo $\text{H}_x\text{AO}_y$, os hidrogênios ligam-se, preferencialmente, aos átomos de oxigênio. Em seguida, os grupos $\text{HO}$ se ligam ao átomo central ($A$) e, finalmente, completam-se as ligações possíveis do átomo A com os átomos restantes.
Propriedades dos compostos moleculares
Os compostos moleculares podem apresentar-se, nas condições ambientes, no estado sólido (açucar, parafina, celulose, enxofre, ácido bórico), no estado líquido (água, álcool, ácido sulfúrico) e no estado gasoso (gás hidrogênio, gás cloridríco, gás carbônico, metano).
Em geral, possuem pontos de fusão e de ebulição baixos, se comparados com os compostos iônicos.
Não conduzem corrente elétrica quando puros. Os compostos covalentes polares que se ionizam conduzem corrente elétrica.


